Методы стимулирования полового созревания производителей при искусственном выращивании рыб получают все большее распространение в связи с ростом масштабов рыбоводства и нарастающими потребностями населения в пищевой продукции. Они позволяют сократить время выдерживания рыб до момента получения зрелых половых продуктов, сдвигать сроки инкубации икры и увеличивать период выращивания молоди в первый вегетационный сезон.
Для получения качественных половых продуктов необходимо учитывать биологические и физиологические особенности разводимых видов рыб, в соответствии с которыми выбирается один из трех разработанных учеными рыбоводами методов стимулирования: экологический, физиологический, комбинированный.
Экологический метод по искусственному воспроизводству рыб
Экологический метод был разработан А. Н. Державиным в 30-х годах XX столетия в связи с началом работ по искусственному воспроизводству реофильных видов рыб, вызванных гидростроительством на крупных нерестовых реках. Он изучал технологии содержания производителей рыб в речной проточной воде и выявил факторы, которые способствуют созреванию половых клеток, овуляции у самок и образованию спермы у самцов. К таким факторам, прежде всего, относятся: течение, температура воды, длина светового дня и нерестовый субстрат.
Было доказано, что:
–– движение рыб против течения воды во время нерестовых миграций и выдерживание производителей в проточной воде оказывают стимулирующее действие на процессы их созревания;
–– повышение температуры воды в нерестовый период стимулирует более раннее созревание половых продуктов;
–– увеличение освещенности (длительности светового дня) при искусственном содержании производителей стимулирует их созревание;
–– отсутствие нерестового субстрата приводит к сбою процессов нереста.
В настоящее время экологический метод широко применяется при проведении работ по воспроизводству в искусственных условиях лососевых и реофильных карповых рыб при выдерживании производителей с целью получения от них зрелых половых продуктов. Также этот метод применяется при искусственном разведении нерестующих осенью рыб, входящих в реки с гонадами ІІ или ІІІ стадиях зрелости.
Сущность экологического метода заключается в следующем:
–– из естественной популяции или искусственно созданного маточного стада отбираются здоровые рыбы, от которых планируется получить половые продукты в ранние сроки;
–– отобранные рыбы размещаются в бассейны или лотки (самки и самцы раздельно);
–– в рыбоводных емкостях устанавливаются условия, близкие к нерестовым;
–– регулируются температурный режим, проточность и освещенность.
В этих условиях происходит интенсивное созревание половых продуктов и рыбы нерестятся на 2−3 месяца раньше, чем в естественных условиях обитания.
Физиологический метод в воспроизводстве рыб
В 30-е годы XX столетия бразильский исследователь Иеринг и русский профессор Н. Л. Гербильский, проводя многочисленные гистологические исследования гипофиза рыб, независимо друг от друга раскрыли механизм его физиологического воздействия на созревание половых продуктов.
Ученые пришли к выводу, что в естественных условиях переход рыбы в нерестовое состояние осуществляется при наличии совокупности определенных факторов внешней среды. Они воспринимаются органами чувств рыбы и через них действуют на центральную нервную систему – на гипоталамус. Клетки гипоталамуса выделяют гормон, активизирующий гормональную деятельность гипофиза.
Выделяемый гипофизом гонадотропный гормон поступает в кровь и стимулирует созревание половых клеток, а также выход зрелых яиц (икринок) из фолликул и образование спермы.
Н. Л. Гербильский установил гонадотропную активность гипофиза рыб в различные периоды годового цикла. Он доказал, что гонадотропные гормоны образуются в гипофизах только половозрелых рыб и поступают в кровеносную систему организма рыбы непостоянно и в различном количестве. В определенные сезоны года гормон в гипофизе накапливается. Наибольшее количество бывает в период, когда половые железы рыб достигают четвертой стадии зрелости, а половые клетки − дефинитивного размера.
Именно в это время гипофизы обладают наивысшей гонадотропной активностью.
Ученый предположил, что при внутримышечных инъекциях производителям суспензии гипофиза рыб гонадотропный гормон, поступая в кровь, будет стимулировать половой процесс. Это приведет к быстрому переходу половых желез производителей из IV в V стадию зрелости и получению от них зрелой, способной к оплодотворению и развитию икры у самок и доброкачественной спермы у самцов.
Следовательно, при искусственном рыборазведении можно получать зрелые половые продукты от производителей путем инъецирования им препарата гипофиза. В этом случае созревание половых клеток,
овуляция и образование спермы происходят, как и при естественном нересте, под влиянием гипофиза. Однако отличие состоит в том, что увеличение количества гонадотропного гормона в крови производителей происходит не под влиянием нерестовых условий, усиливающих выделение собственного гонадотропного гормона, а при помощи введения им взятых гипофизов от других рыб.
Метод гипофизарных инъекций
В 1936 году Н. Л. Гербильским был разработан метод гормональной стимуляции созревания половых клеток у рыб. Он был назван методом гипофизарных инъекций. В дальнейшем этот метод был усовершенствован И. А. Баранниковой и другими учениками Н. Л. Гербильского.
Метод гипофизарных инъекций основан на введении производителям весенне- и летне-нерестующих видов рыб (осетр, карп, лещ, судак, белый амур и др.) препарата гипофиза. Он позволяет ускорить протекание завершающих стадий полового созревания рыб либо преодолеть тормозящее действие условий их содержания на развитие половых продуктов.
До разработки препаратов заменителей гонадотропных гормонов на рыбоводных хозяйствах для приготовления необходимых инъекций использовали гипофизы, которые заготавливались осенью (карповые), зимой (лососевые и осетровые) и ранней весной (теплолюбивые, растительноядные) во время промысла рыб.
Заготовка гипофизов
При заготовке гипофизов следует соблюдать следующие требования:
–– рыбы, у которых изымаются гипофизы, должны быть живыми;
–– заготовку гипофизов следует проводить в преднерестовый период, когда половые продукты производителей находятся на IV стадии зрелости;
–– нельзя получать гипофизы от неполовозрелых, старых, только что отнерестившихся и больных рыб;
–– нельзя допускать раздавливания или разрыва гипофиза при извлечении;
–– не следует смешивать гипофизы самок и самцов, так как физиологическая активность такой партии снижается, что затрудняет выбор дозировки.
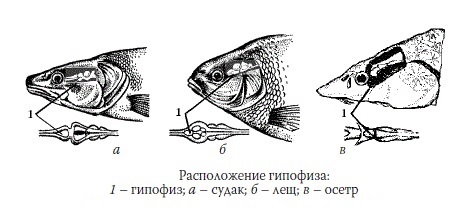
Расположение гипофиза у рыб разных видов имеет свои особенности (рис. 6). Это следует учитывать при их извлечении.
Перед заготовкой гипофизов у живой рыбы перерезают жабры для обескровливания. У частиковых видов ножницами срезают верхние кости черепа и пинцетом приподнимают мозг. У судака гипофиз остается прикрепленным к мозгу или лежит в ямке у основания черепа, откуда его можно извлечь пинцетом. У карповых рыб гипофиз лежит в ямке у основания черепа и почти целиком покрыт тонкой пленкой, через которую его хорошо видно. После удаления мозга края этой пленки осторожно подрезают скальпелем и пинцетом извлекают гипофиз. У осетровых рыб при помощи трепана (металлический цилиндр с пилообразными зубцами по нижнему краю) просверливают кости черепа по средней линии головы позади глаз. Взяв высверленный кусок в руки, срезают с него нижнюю костную пластину и хрящ, а затем извлекают пинцетом гипофиз. Необходимо следить за тем, чтобы целостность гипофиза не была нарушена.
Расположение гипофиза
Извлеченные у рыб гипофизы помещаются в стеклянные банки с плотно притертыми крышками и трехкратно обрабатываются химически чистым ацетоном (в первый раз через 1 час, во второй − через 12 часов, в третий − через 6 часов). Возможна и двукратная обработка − через 10 и 8 часов. На 1 объем гипофизов используется 10−15 объемов ацетона. После обработки ацетон сливают, а гипофизы раскладывают на фильтровальную бумагу и высушивают при комнатной температуре, не допуская попадания прямых солнечных лучей. Во время сушки нельзя подогревать гипофизы. Даже незначительное повышение температуры приводит к полной потере активности гонадотропных гормонов.
Хранить гипофизы следует в пробирках, плотно закрытых пробками, или в герметически закрытой темной посуде, переложив марлевыми салфетками, при температуре 1−5 °С. В таком состоянии гипофизы могут храниться, не теряя своей активности, в течение нескольких лет. На посуде с гипофизами наклеивают, а в пробирки вкладывают этикетки с указанием вида и пола рыбы, места и времени сбора, количества гипофизов и фамилии заготовителя. Высокая влажность и освещение действуют на гипофизы губительно.
Оптимальный цвет заготовленных гипофизов − белый или слегка желтоватый. Некачественный продукт имеет буроватые, слизистые или кровяные вкрапления, легко крошится. Его введение может привести к появлению язвы на месте укола, некрозу тканей и гибели производителей.
Для приготовления гипофизарных препаратов пробирки с гипофизами достают из холодильника и в течение 1–1,5 часа выдерживают при комнатной температуре. Только после этого их открывают и извлекают гипофизы. В противном случае произойдет увлажнение гипофизов из-за запотевания стенок пробирки.
Приготовление гипофизарных инъекций
Инъецируют гипофизы рыбам в виде суспензии мелко размолотого порошка, размешанного в физиологическом растворе или в воде.
Суспензия теряет свои качества в течение нескольких часов, поэтому ее готовят и набирают в шприцы за 30–40 минут до начала инъекций.
Суспензию готовят не для каждого производителя отдельно, а для всей группы отсаженных самок с некоторым запасом, учитывая возможные ее потери. Расчет количества гипофизов, необходимых для инъекций, производят, взвешивая всю партию имеющихся гипофизов и определяя среднюю массу одного из них. Зная массу одного гипофиза, количество, общую массу производителей и норму гипофиза, отсчитывают необходимое число гипофизов для каждой инъекции.
При инъекции недоброкачественного гормона на теле рыб в месте укола образуется язва, которая, как правило, ведет к некротическим изменениям в тканях рыб и дальнейшей гибели производителей.
Для приготовления гипофизарных инъекций отбирают хорошо высушенные, целые, сохранившие свою форму, белые или светло-коричневые гипофизы. При приготовлении суспензии рекомендуется использовать физиологический раствор (6,5 г чистого хлористого натрия или нейодированной поваренной соли на 1 литр дистиллированной воды). При отсутствии физиологического раствора можно использовать кипяченую, охлажденную профильтрованную воду.
Взвешенные гипофизы измельчают, помещают в фарфоровую ступку и тщательно растирают пестиком до порошкообразного состояния. Затем в ступку с порошком шприцем добавляют небольшое количество физиологического раствора и продолжают растирать гипофизы до получения однородной кашицеобразной массы. После этого в ступку добавляют раствор до нужного объема, исходя из нормы 0,5 или 1 мл на одного производителя. Для гипофизарных инъекций в виде исключения можно использовать также свежезаготовленные гипофизы, растертые до тонкой взвеси в физиологическом растворе. В таком случае к суспензии гипофиза для дезинфекции добавляют антибиотик (мономицин, леворин, полимиксин (100 ед/мл), бициллин-5 и др.).
Определение активности препарата гипофиза
Количество вводимой суспензии гипофиза зависит от ее активности. Активность препарата определяют с помощью тест-объектов, в качестве которых используют самок вьюна или самцов лягушек. Для определения активности препарата гипофиза во вьюновых единицах (ВЕ) используют несколько групп самок вьюна с гонадами IV стадии зрелости и индивидуальной массой 35−40 г. При температуре 16–18 °С всем им одновременно делают гипофизарные инъекции различной дозировки. Минимальная дозировка препарата гипофиза (мг), которая вызывает у одной самки вьюна созревание ооцитов и овуляцию, соответствует вьюновой единице.
Таким же образом проверяют эффективность препарата гипофиза на самцах лягушек. Положительной реакцией считается появление подвижных сперматозоидов в клоаке самца после инъекции суспензии гипофиза в спинные лимфатические мешки при температуре 18–22 °С. При этом гонадотропная активность гипофиза выражается в лягушачьих единицах (ЛЕ) – минимальном весовом количестве препарата гипофиза, которое вызывает реакцию спермации у одного самца лягушки.
Проведение гипофизарных инъекций
Гормональное стимулирование производителей начинают при температуре воды, близкой к значениям, оптимальным для инкубации икры. Инъецируют рыб в сырых брезентовых носилках или на специальном столе с мягким покрытием или непосредственно в бассейнах, приспуская воду настолько, чтобы верхняя часть спины рыбы находилась над водой.
Существует три схемы инъекций:
1. Однократная инъекция, при которой вся доза препарата вводится рыбе единовременно. Такая схема применима исключительно к очень зрелым самкам и обычно практикуется для самцов.
2. Дробные инъекции, при которых доза препарата делится на равные части, вводимые рыбе через определенные промежутки времени.
При такой схеме последняя инъекция называется разрешающей, а все остальные предварительными.
3. Градуальные инъекции, при которых доза делится на неравные части, при этом обычно наибольшая часть вводится последней и называется разрешающей, остальные − предварительными.
Иногда в схеме дробных и градуальных инъекций предусмотрено введение дополнительной дозы препарата после разрешающей инъекции. Эта доза называется завершающей и применяется, когда необходимо увеличить концентрацию препарата в крови после начала действия разрешающей инъекции
Для инъекций используют одноразовые медицинские шприцы.
Длину (2,5–3,8 см) и диаметр иглы, а также объем шприца (10–20 мл) подбирают в зависимости от размера рыбы, дозы и типа препарата.
При использовании ацетонированных гипофизов необходимо использовать иглы большего диаметра (для внутривенных инъекций).
Инъекцию производят в спинные мышцы рыбы несколько выше боковой линии и ниже основания спинного плавника под углом 45о.
Карповым видам рыб игла вводится под чешую, а осетровым − между спинными и боковыми жучками на уровне 2−4-й спинной жучки.
Место прокола при этом придерживается пальцем, и после удаления иглы несколько секунд массируется, чтобы введенная суспензия не вылилась обратно (рис).
Существуют методики по инъецированию рыб под брюшные и грудные плавники, а также прямо в полость тела, но для этого нужен опыт, можно случайно проколоть внутренние органы и даже сердце. При инъекции препарат не должен вводиться подкожно, опасно также слишком глубокое введение иглы.
Если одной рыбе производят 2 инъекции, то второй укол необходимо делать в другую сторону спины, чтобы избежать потерь препарата через отверстие, оставшееся после первой инъекции.
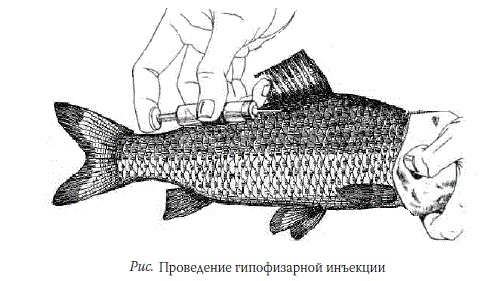
Время начала инъецирования рассчитывают таким образом, чтобы получение половых продуктов приходилось на дневное время.
Для самок применяют двукратную инъекцию с интервалом в 12−14 часов. Первая инъекция является предварительной и ее доза составляет 1/8−1/10 общей дозы препарата. Остальное количество препарата вводится во вторую (разрешающую) инъекцию.
Самцам препарат вводят один раз (примерно половину дозы для самки) одновременно с введением самкам последней порции гормона. Общая доза препарата зависит от температуры воды и массы рыбы, а доля предварительной инъекции − от степени зрелости ооцитов.
Наилучшие результаты при инъецировании производителей карпа и сазана получают из расчета 3−5 мг сухого вещества гипофиза на 1 кг массы тела самки и 1,5 мг/кг массы тела самца. Самкам растительноядных рыб (белый амур, белый толстолобик и пестрый толстолобик) массой 3−5 кг вводят 3 мг препарата гипофиза на рыбу, более крупным – 5–6 мг. Самцам массой 5−7 кг вполне достаточно 4−6 мг гипофиза на рыбу, более крупным вводят 12–15 мг вещества гипофиза.
Для осетровых рыб применяют следующие дозировки: для самок – от 2 до 10 мг/кг, для самцов – от 1 до 4 мг/кг.
Дозы гонадотропных гормонов для стимуляции созревания различных видов рыб
| Тип инъекции | Доза гормона | Происхождение гонадотропного гомона | ||
| мг/кг | ЛЕ на рыбу | |||
| КАРП | ||||
| Самки | предварительная | 0,2 - 0,5 | - | Карп, сазан, лещ |
| разрешающая | 2,0 - 1,5 | - | ||
| Самцы | 1,0 - 1,5 | - | ||
| ЛЕЩ | ||||
| Самки | 2,0 - 2,5 | 13 - 17 | Лещ, сазан | |
| Самцы | 0,5 - 1,0 | 3 -7 | ||
| ЩУКА | ||||
| Самки | 3,0 - 4,0 | - | Щука | |
| Самцы | 1,5 - 2,0 | - | ||
| СУДАК | ||||
| Самки | - | 200 - 500 ме | Хориогонин | |
| Самцы | - | 50 - 150 ме | ||
| ТОЛСТОЛОБИКИ, АМУРЫ, БУФФАЛО | ||||
| Самки | предварительная | 0,5 - 1,0 | 250 ме/кг | Лещ, сазан / хориогонин |
| разрешающая | 3,0 - 6,0 | 2500 ме/кг | ||
| Самцы | 1,0 - 1,5 | 250 - 500 ме/кг | ||
| КАНАЛЬНЫЙ СОМ | ||||
| Самки | предварительная 1 | 1,0 | 1 - 2 тыс. ме | Сазан, лещ, толстолобики, сом / хориогонин для всех |
| предварительная 2 | 2,0 | 4 - 8 тыс. ме | ||
| разрешающая | 10,0 | 6 - 12 тыс. ме | ||
| Самцы | 2,5 - 5,0 | 4 - 8 тыс.м е | ||
| РУССКИЙ ОСЕТР, СЕВРЮГА | ||||
| Самки | предварительная | - | 3 | Осетровые рыбы |
| разрешающая | - | 70 - 80 | Осетровые рыбы, лещ, сазан | |
| Самцы | - | 50 - 70 | Осетровые рыбы, лещ, сазан | |
| БЕЛУГА | ||||
| Самки | - | 500 - 660 | Осетровые рыбы | |
| Самцы | - | 125 - 165 | ||
| ЛЕНСКИЙ ОСЕТР | ||||
| Самки | 3,2 | - | Осетровые рыбы | |
| Самцы | 2,0 | - | ||
МЕ - мышиная единицы для хориогонина
Следует учитывать, что истощенные рыбы более чувствительны к гипофизарным инъекциям, поэтому в данном случае дозировки препаратов необходимо снижать. В то же время превышение дозы гипофиза вызывает прекращение развития зародышей на последних стадиях эмбриогенеза. В результате выклюнувшиеся предличинки обладают слабым, размягченным желточным мешком и погибают в течение первых пяти суток.
При проведении инъекций для предупреждения травмирования производителей применяют различные анестизирующие препараты (трихлорбутилалкоголь, ихтиокальм, хинальдин и др.), после чего рыба обязательно помещается в проточную воду.
После проведения инъекций самцов и самок содержат раздельно и за 2−3 часа до ожидаемых сроков созревания проводят осмотр.
Специфичность действия гипофизов рыб
Гипофизы рыб разных семейств обладают специфичностью действия. Так, известно, что гормоны окуневых не стимулируют созревание половых клеток карповых, а препараты гипофиза лососевых рыб вызывают созревание ооцитов у карповых лишь в больших дозах.
Положительная реакция у осетровых наблюдается только при введении им гипофизов, взятых у особей этого же семейства, или при введении гипофиза леща.
Гипофизы сазана, карпа, леща и сома стимулируют созревание половых клеток только у особей семейства карповых, сома, судака и щуки. Самым широким спектром действия обладают гипофизы карпа (таблица).
Современные гормональные препараты
В связи с постоянным ростом масштабов рыборазведения и сокращением в естественных водоемах промысловых запасов сазана и осетра, гипофизы которых используются в рыбоводстве, возникла необходимость их замены другими гормональными препаратами.
В настоящее время как российскими, так и зарубежными учеными ведутся разработки таких препаратов в трех основных направлениях.
Первое из них связано с заменой гонадотропина гипофиза рыб другими гонадотропными препаратами, имеющими гипофизарное или плацентарное происхождение. К числу таких заменителей
Возможные варианты использования гипофизов разных видов рыб
| Производители | Сазан, карп | Рыбец | Карась | Щука | Осетровые | Лососи | Корюшка | Чехонь | Толстолобик | Сельдевые | Окунь | Судак | Белорыбица | Сиги |
| Осетровые | + | + | + | - | ||||||||||
| Лососи | + | + | ||||||||||||
| Форель | + | + | ||||||||||||
| Кумжа | + | |||||||||||||
| Сиг | + | + | + | + | + | + | ||||||||
| Хариус | + | + | + | |||||||||||
| Корюшка | + | |||||||||||||
| Белый амур | + | + | + | |||||||||||
| Линь | + | + | ||||||||||||
| Лещ | + | + | + | + | - | - | - | |||||||
| Рыбец | + | + | + | - | + | + | - | |||||||
| Сазан, карп | + | + | - | + | - | + | ||||||||
| Судак | + | + | + | + | + |
Примечание: «+» − благоприятные; «+» − допустимые; «−» − неприемлемые.
относится: хориогонин (хорионический гонадотропин), используемый для стимулирования полового созревания судака, белого и пестрого толстолобиков, и препарат сыворотки крови жеребых кобыл (СЖК), который вводится форели и карпу.
Второе направление ориентировано на использование рилизинг-гормонов, которые могут активизировать собственный гипофиз рыбы. В эту группу входят такие гормональные препараты, как Суфрагон (ЛГ-РГ-А), Оваприм, Оватид, Овапель, GnRH, которые используют для стимулирования самок карповых и осетровых рыб, а также Нерестин, пригодный для любых видов рыб.
Третье направление связано с использованием стероидных гормонов, которые воздействуют на ооциты, вызывая их созревание и овуляцию.
В настоящее время гипофизарные препараты широко используются: в осетроводстве, причем в последние годы не только при разведении, но и при получении пищевой икры; в карповодстве; при воспроизводстве растительноядных рыб (белый и пестрый толстолобики, белый и черный амуры); в сомоводстве и в аквариумистике.
Более ограниченное применение они находят при разведении кефалеобразных, камбалообразных, лососеобразных, окунеобразных и других видов рыб.
Совместное содержание самок и самцов
К физиологическим методам стимулирования созревания половых продуктов производителей рыб также можно отнести совместное содержание самок и самцов перед нерестом. При смешанной посадке самки стимулируют созревание половых продуктов у самцов, а выделяемый в воду самцами стероидный гормон копулин оказывает стимулирующее действие на созревание гонад у самок.
Кормление производителей
Правильное питание производителей также можно отнести к физиологическим методам стимулирования полового созревания рыб в связи с тем, что рыба производит зрелые половые продукты только тогда, когда достигает определенной массы и упитанности. Поэтому использование специализированных кормов для производителей во время нерестового периода может способствовать их быстрейшему созреванию.
Комбинированный (эколого-физиологический) метод разведения рыб
Во второй половине XX века советские ученые разработали и внедрили в производство эколого-физиологический метод, который предусматривает стимулирование созревания половых продуктов у производителей путем комбинированного воздействия на организм рыбы экологических факторов среды и вводимых физиологически активных веществ.
В настоящее время этот метод широко используется на российских рыбоводных предприятиях, что позволяет получать необходимое количество икры и спермы к определенному времени.