Диагностические инструменты, используемые при диагностике болезней рыб
Диагностика болезней рыб это ярлык, присваиваемый медицинскому состоянию или заболеванию, идентифицируемому по его признакам, симптомам и результатам различных диагностических процедур. Термин "диагностические критерии" обозначает комбинацию признаков, симптомов и результатов анализов, которая позволяет клиницисту установить диагноз соответствующего заболевания. Это может быть определение как "распознавание болезни или состояния по его внешним признакам и симптомам" или "анализ лежащих в основе физиологических / биохимических причин болезни или состояния"."Диагностика заболеваний относится к различным процедурам и техникам, используемым для определения природы заболевания и точного определения первичных и вторичных патогенов. Правильный диагноз приводит к точной терапии и позволяет избежать неразборчивого использования химиотерапевтических средств. Диагностика заболеваний является неотъемлемой частью управления здоровьем водных организмов. Правильный диагноз помогает назначить точную терапию и избежать неразборчивого применения химиотерапевтических средств. При исследовании образцов для постановки диагноза следует тщательно использовать информацию об истории болезни и клинических признаках.
Важность истории болезни
Информация из истории болезни очень важна для правильной диагностики заболевания и принятия надлежащих мер по исправлению положения. Во время вспышки заболевания тщательное изучение истории болезни поможет точно определить обстоятельства, при которых развилось заболевание. Некоторые истории болезни, которые принимаются во внимание, являются,
- Качество воды
- Процент кормления
- Потребление корма
- График внесения удобрений
- Время последнего цветения водорослей
- Детали известкования
- Детали лечения
- Источник семян, сведения о запасах
Классификация методов диагностики заболеваний
Методы диагностики заболеваний могут быть классифицированы по следующим типам
- Микроскопическая диагностика
- Гистологический диагноз
- Микробиологическая диагностика
- Иммунологическая диагностика
- Молекулярная диагностика
Микроскопическая диагностика
Без микроскопа просто невозможно определить разницу между качеством воды и проблемой паразитов. Микроскоп следует считать самым основным инструментом в диагностике болезней рыб. Микроскопию можно выполнить быстро, но точность зависит от опыта микроскописта и качества оборудования. Большинство образцов обрабатывают пятнами, которые окрашивают патогенные микроорганизмы, заставляя их выделяться на фоне, хотя влажные образцы неокрашенных образцов можно использовать для обнаружения грибков, паразитов (включая яйца и личинки гельминтов) и подвижных организмов. Видимость грибков может быть увеличена путем нанесения 10% гидроксида калия (KOH) для растворения окружающих тканей и немелочковых организмов.
Окрашивание основано на вероятных патогенах, но ни одно пятно не является на 100% специфичным. Большинство образцов обрабатывают окраской по граму, а при подозрении на микобактерии - кислотостойкой окраской. Однако некоторые патогены нелегко обнаружить с помощью этих пятен; если подозреваются эти патогены, требуются другие пятна или другие методы идентификации, поскольку для микроскопического обнаружения обычно требуется концентрация микробов примерно в 1 раз 105/мл.
Микроскопы, которые обычно используются при диагностике болезней рыб, являются
- Световой микроскоп
- Электронный микроскоп
Световой микроскоп
Световой микроскоп является наиболее часто используемым микроскопом в диагностике заболеваний. С помощью этого микроскопа можно непосредственно визуализировать соскобы с рыбы или подготовить кусочек органа для исследования. Он также может быть использован для интерпретации гистологических слайдов и окрашенных микроорганизмов.
Электронный микроскоп
В целом они подразделяются на два типа
Просвечивающая электронная микроскопия
Они используются для наблюдения за изменениями в ткани при большем увеличении.
Сканирующая электронная микроскопия
Они используются для наблюдения за изменениями уровня поверхности в тканях при большем увеличении.
Гистологический диагноз
Гистология - это раздел биологии, который включает микроскопическое исследование тонких окрашенных срезов тканей с целью изучения их структуры и функции, а в случае гистопатологии - для определения изменений, которые могут быть вызваны патогенами и болезнями. Гистология и имеют центральную роль в диагностике заболеваний.Срезы окрашенной ткани рыбы подготавливаются и исследуются с помощью световой микроскопии. Идентифицируются и описываются изменения тканей, возникающие в результате инфекционного или неинфекционного заболевания. Иммуногистохимические методы также используются для выявления специфических патогенов в срезах тканей.
Подготовка
После отбора проб ткани рыбы помещают в водный фиксатор. Этот фиксатор сохраняет морфологию (структуру и химические составляющие) тканей и клеток, так что они способны выдерживать дальнейшие подготовительные этапы без изменений. Важно, чтобы ткани были зафиксированы в течение очень короткого времени после смерти, чтобы избежать распада тканей или клеток под действием их собственных ферментов. После фиксации ткани постепенно обезвоживают, чтобы удалить из них воду, используя серию градуированных спиртов. Затем ткани "очищаются", что включает обработку веществом, которое полностью смешивается как с обезвоживающей жидкостью, так и с заделывающим агентом. Затем ткани погружают в расплавленный парафин и охлаждают для отверждения воска, чтобы с помощью микротома можно было вырезать тонкие срезы и затем закрепить на предметных стеклах микроскопа. Воск удаляют с срезов перед окрашиванием.
Окрашивание
После очистки и регидратации срезы ткани можно окрашивать с помощью биологических пятен или красителей. Гематоксилин и эозин (H & E) являются наиболее широко используемым гистологическим окрашиванием из-за его способности выявлять широкий спектр различных компонентов ткани. Окраска по Грамму - это метод окрашивания для дифференциации микроорганизмов. Метод основан на способности клеточных стенок бактерий удерживать кристаллический фиолетовый краситель в окраске по граму во время обработки растворителем. Клеточные стенки грамположительных микроорганизмов сохраняют первичный фиолетовый цвет, поскольку они имеют более высокое содержание пептидогликанов (сахаров) и более низкое содержание липидов, чем грамотрицательные бактерии. Периодическая реакция кислотного Шиффа (PAS) используется для демонстрации определенных углеводов, которые присутствуют в некоторых тканях, и обеспечивает идентификацию заражающего грибка в тканях рыбы. PAS-положительные участки окрашиваются в розовый / красный цвет.
Иммуногистохимия
Были разработаны методы иммуногистохимического окрашивания для выявления вирусов, таких как вирус инфекционного панкреонекроза (IPNV), вирус инфекционной анемии лосося (ISAV) и нодавирус, в срезах тканей, пропитанных парафином. Вирусный антиген локализуется антителом, выделенным против вируса, и последующие этапы обнаружения приводят к окрашенному продукту, который можно визуализировать с помощью световой микроскопии
Гистологические методы позволяют описать патологию тканей и выделить последовательность клеточных изменений и их прогрессирование, вызванные инфекционными и неинфекционными заболеваниями. Исследуя окрашенные срезы, можно идентифицировать вирусы, бактерии, грибы и паразитов, а с помощью иммуногистохимических методов можно обнаружить определенные инфекционные агенты в срезах тканей. Расширенное использование FRS инструментов анализа изображений позволяет генерировать качественные данные для улучшения диагностики заболеваний.
Микробиологическая диагностика
Бактериальные заболевания могут быть идентифицированы различными микробиологическими методами. Образцы отбираются у рыбы в асептических условиях и сначала выращиваются в неселективных средах, затем используются различные методы микробиологической диагностики. Различные микробиологические методы диагностики являются
- Методы окрашивания
- Тест на подвижность
- Культивирование в селективной среде
- Биохимический тест
Метод окрашивания
Для идентификации различных бактериальных патогенов используются различные методы окрашивания, среди которых окрашивание по граму является наиболее важным и наиболее часто используемым методом.
Окраска по граму: Окраска по граму классифицирует бактерии в зависимости от того, сохраняют ли они кристаллическую фиолетовую окраску (грамположительная — синяя) или нет (грамотрицательная — красная), и выделяет морфологию клеток (например, бациллы, кокки) и расположение клеток (например, скопления, цепочки, диплоиды). Такие характеристики могут направлять антибактериальную терапию до окончательной идентификации. Для окрашивания по граму специалисты нагревают материал образца на предметном стекле и окрашивают его путем последовательного воздействия кристаллического фиолетового Грамма, йода, обесцвечивающего средства и противоокрашивающего средства (обычно сафранина).
Кислотостойкие и умеренно (модифицированные) кислотостойкие пятна: Эти пятна используются для идентификации кислотоустойчивых организмов (Микобактерии sp) и умеренно кислотоустойчивых организмов (в первую очередь Нокардия sp). Эти пятна также полезны для окрашивания Rhodococcus и родственных родов, а также ооцисты некоторых паразитов (например, Криптоспоридий).
Флуоресцентные пятна: Эти пятна позволяют обнаруживать при более низких концентрациях (1 104 клеток/мл). Примерами являются акридиновый оранжевый (бактерии и грибы), аурамин-родамин и аурамин О (микобактерии) и калькофторид белый (грибы, особенно дерматофиты). Соединение флуоресцентного красителя с антителом, направленным на патоген (прямая или непрямая иммунофлуоресценция), теоретически должно повысить чувствительность и специфичность. Однако эти тесты трудно читать и интерпретировать, и немногие (например, Пневмоцист и Легионелла прямые флуоресцентные тесты на антитела) коммерчески доступны и широко используются.
Окрашивание индийскими чернилами (коллоидный углерод): Это окрашивание используется для обнаружения в основном инкапсулированных грибов в клеточной суспензии. Окрашивается фоновое поле, а не сам организм, что делает любую капсулу вокруг организма видимой в виде ореола. Лейкоциты могут казаться инкапсулированными.
Пятно Райта и пятно Гимзы: Эти пятна используются для обнаружения паразитов в крови, фагоцитах и клетках тканей, внутриклеточных включений, образованных вирусами и некоторыми внутриклеточными бактериями.
Окрашивание трихромом (окрашивание Гомори-Уитли) и окрашивание гематоксилином железа: Эти пятна используются для обнаружения кишечных простейших. Окраска Гомори-Уитли используется для обнаружения микроспоридий. В нем могут отсутствовать яйца и личинки гельминтов. Окрашивание гематоксилином железа дифференцированно окрашивает клетки, клеточные включения и ядра. Яйца гельминтов могут окрашиваться в слишком темный цвет, чтобы их можно было идентифицировать.
Тест на подвижность
Гистологические методы позволяют описать патологию тканей и выделить последовательность клеточных изменений и их прогрессирование, вызванные инфекционными и неинфекционными заболеваниями. Исследуя окрашенные срезы, можно идентифицировать вирусы, бактерии, грибы и паразитов, а с помощью иммуногистохимических методов можно обнаружить определенные инфекционные агенты в срезах тканей. Расширенное использование FRS инструментов анализа изображений позволяет генерировать качественные данные для улучшения диагностики заболеваний.
Существует три метода определения подвижности бактерий, и они
- Метод подвесных капель
- Метод полутвердого агара (Craigie)
- Метод трех покровных стекол
Метод подвесных капель
- Поместите небольшую каплю жидкой бактериальной культуры в центр покровного стекла
- Поместите небольшую каплю воды в каждый угол покровного стекла
- Переверните предметное стекло с центральным углублением над покровным стеклом
- Покровное стекло прилипнет к предметному стеклу, и когда предметное стекло перевернуто, капля бактериальной культуры будет взвешена в лунке
- Исследуйте под микроскопом (x400) подвижные организмы
Примечание: Если предметные стекла недоступны, вместо них можно сделать кольцо из вазелина или пластилина на обычном предметном стекле микроскопа
Положительный результат: метание, зигзагообразное, кувыркающееся или другое организованное движение
Отрицательный результат: нет движения или только броуновское движение.
Полу Метод твердого агара (Craigie)
- Инокулируйте исследуемый организм - центральную стеклянную трубку
- Инкубировать при соответствующей температуре в течение 18-24 часов
- Субкультура из внешней части среды
Положительный результат: организм может быть извлечен из внешней части среды
Отрицательный результат: организм остается во внутренней пробирке
Метод трех покровных стекол
- Установите предметное стекло микроскопа в соответствии с рисунком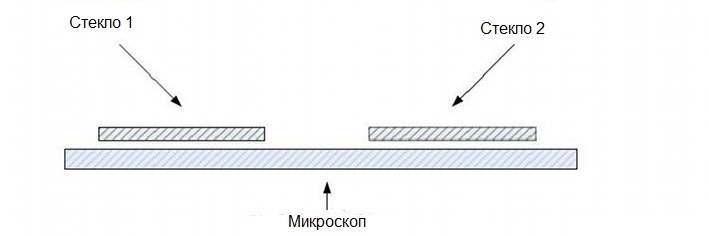
- Поместите небольшую каплю бактериальной культуры в центр третьего покровного стекла.
- Поместите небольшую каплю воды в каждый угол покровного стекла.
- Переверните подготовленное предметное стекло микроскопа над третьим покровным стеклом.
- Покровное стекло должно прилипать к другим покровным стеклам на предметном стекле, и при переворачивании капля бактериальной культуры должна находиться в промежутке между предметным стеклом микроскопа и третьим покровным стеклом.
- Исследуйте под микроскопом (x400) подвижный организм.
Положительный результат: метание, зигзагообразное, кувыркающееся или другое организованное движение.
Отрицательный результат: нет движения или только броуновское движение.
Культивирование патогенных бактерий в селективной среде
Некоторые бактерии обладают способностью расти в селективных средах. Это свойство бактерий используется для идентификации бактериального патогена. Только определенный вид бактерий может расти в селективных средах. Примером селективной среды является TCBS для Вибрионы.
Биохимические тесты
Различные биохимические тесты используются для идентификации бактерий на основе характера конкретной бактерии, чтобы дать положительный и отрицательный результат для конкретного биохимического теста.
Тест на индол
Исследуемый организм инокулируют в триптоновый бульон, богатый источник аминокислоты триптофан. Индолположительные бактерии, такие как кишечная палочка, продуцируют триптофаназу, фермент, который расщепляет триптофан, производя индол и другие продукты. Когда реагент Ковача (п-диметиламинобензальдегид) добавляют в бульон с индолом, в нем появляется темно-розовый цвет. Результаты индольного теста должны быть получены к 48 часам инкубации, поскольку при длительной инкубации индол может подвергнуться дальнейшему разложению. Кислотный уровень pH, вырабатываемый кишечной палочкой, ограничивает ее рост.
Метиловый красный и тесты Вогеса-Проскауэра
Анализы метилового красного (MR) и Фогеса-Проскауэра (VP) считываются из одной пробирки с бульоном MR-VP. После 24-48 часов инкубации бульон MR-VP разделяют на две пробирки. Одна трубка используется для МР-теста; другая используется для теста VP. Среда содержит глюкозу и пептон. Все энтеросолюбильные вещества окисляют глюкозу для получения энергии; однако конечные продукты варьируются в зависимости от бактериальных ферментов. Тесты MR и VP используются для определения того, какие конечные продукты образуются, когда исследуемый организм разлагает глюкозу. E. coli - одна из бактерий, которая вырабатывает кислоты, вызывающие падение рН ниже 4,4. Когда в этот кислый бульон добавляют индикатор pH метиловый красный, он становится вишнево-красным (положительный МР-тест). Klebsiella и Enterobacter производят более нейтральные продукты из глюкозы (например, этиловый спирт, ацетилметилкарбинол). При таком нейтральном рН рост бактерий не подавляется. Таким образом, бактерии начинают атаковать пептон в бульоне, вызывая повышение рН выше 6,2. При этом значении рН индикатор метилового красного имеет желтый цвет (отрицательный МР-тест).
Реагентами, используемыми для теста VP, являются реагенты Барритта A (альфа-нафтол) и Барритта B (гидроксид калия). Когда эти реагенты добавляют в бульон, в котором присутствует ацетилметилкарбинол, они приобретают розово-бордовый цвет (положительный тест VP). Для появления этого цвета может потребоваться от 20 до 30 минут.
Тест на каталазу
Каталаза - это фермент, который расщепляет перекись водорода (H2O2) на H2O и O2. Перекись водорода часто используется в качестве местного дезинфицирующего средства для ран, а наблюдаемое пузырение обусловлено выделением газа O2. H2O2 является мощным окислителем, который может нанести ущерб клетке; из-за этого любая клетка, которая использует O2 или может жить в присутствии O2, должна иметь способ избавиться от перекиси. Одним из таких способов является выработка каталазы.
Тест на цитрат
В цитратном тесте используются цитратные среды Simmon, чтобы определить, может ли бактерия расти, используя цитрат в качестве единственного источника углерода и энергии. Среда Симмона содержит бромтимоловый синий, индикатор рН в диапазоне от 6,0 до 7,6. Бромтимоловый синий имеет желтый цвет при кислом рН (около 6) и постепенно меняется на синий при более щелочном рН (около 7,6). Неокультуренный цитратный агар Симмона имеет рН 6,9, поэтому он имеет промежуточный зеленый цвет. Рост бактерий в среде приводит к развитию цвета берлинской лазури (положительный цитрат). Энтеробактерии и клебсиелла являются цитрат-положительными, в то время как E.coli отрицательный.
Оксидазный тест
Оксидазный тест идентифицирует организмы, которые продуцируют фермент цитохромоксидазу. Цитохромоксидаза участвует в цепи переноса электронов, перенося электроны от молекулы-донора к кислороду. Оксидазный реагент содержит хромогенный восстановитель, который представляет собой соединение, изменяющее цвет при окислении. Если исследуемый организм вырабатывает цитохромоксидазу, оксидазный реагент станет синим или фиолетовым в течение 15 секунд.
Тест на снижение содержания нитратов
Нитратный бульон используется для определения способности организма восстанавливать нитрат (NO3) до нитрита (NO2) с помощью фермента нитратредуктазы. Он также проверяет способность организмов выполнять нитрификацию нитратов и нитритов с образованием молекулярного азота. Нитратный бульон содержит питательные вещества и нитрат калия в качестве источника нитратов. После инкубации нитратного бульона добавьте капельницу сульфаниловой кислоты и α-нафтиламина. Если организм восстановил нитрат до нитрита, нитриты в среде образуют азотистую кислоту. При добавлении сульфаниловой кислоты она вступает в реакцию с азотистой кислота для получения диазотированной сульфаниловой кислоты. Это реагирует с α-нафтиламином с образованием соединения красного цвета. Поэтому, если среда становится красной после добавления нитратных реагентов, это считается положительным результатом для снижения содержания нитратов.Если среда не становится красной после добавления реагентов, это может означать, что организму не удалось уменьшить содержание нитрата, или это может означать, что организм смог денитрифицировать нитрат или нитрит с образованием аммиака или молекулярного азота. Следовательно, в тестировании необходим еще один шаг. Если среда не покраснела после добавления нитратных реагентов, добавьте небольшое количество порошкообразного цинка. Будьте осторожны, так как порошкообразный цинк опасен! Если трубка становится красной после добавления цинка, это означает, что присутствовал невосстановленный нитрат. Следовательно, красный цвет на втором этапе является отрицательным результатом. Добавление цинка превращало нитрат в нитрит, а нитрит в среде образовывал азотистую кислоту, которая вступала в реакцию с сульфаниловой кислотой. Полученная таким образом диазотированная сульфаниловая кислота вступила в реакцию с α-нафтиламином с образованием красного комплекса. Если среда не становится красной после добавления порошка цинка, то результат называется положительным полным. Если красный цвет не образуется, значит, не было нитрата для уменьшения. Поскольку в среде также не было нитритов, это означает, что произошла денитрификация и образовался аммиак или молекулярный азот.
Уреазный тест
Уреазный бульон - это дифференциальная среда, которая проверяет способность организма вырабатывать экзофермент, называемый уреазой, который гидролизует мочевину до аммиака и диоксида углерода. Бульон содержит два буфера pH, мочевину, очень небольшое количество питательных веществ для бактерий и индикатор pH фенол красный. Фенольный красный становится желтым в кислой среде и фуксирующим в щелочной среде. Если мочевина в бульоне разлагается и образуется аммиак, создается щелочная среда, и среда приобретает розовый цвет. Многие энтеросолюбильные препараты могут гидролизовать мочевину; однако лишь немногие способны быстро разлагать мочевину. Они известны как организмы, "быстро положительные на уреазу". Представители рода Протей включены в число этих организмов. Бульон из мочевины разработан для быстрого выявления организмов, положительных на уреазу. Ограниченное количество питательных веществ в сочетании с использованием буферов рН не позволяют всем организмам, кроме организмов, положительных к уреазе, вырабатывать достаточно аммиака, чтобы превратить фенол в красно-розовый.
Фенольный красный бульон
Фенольный красный бульон - это универсальная тестовая среда, обычно используемая для дифференциации грамотрицательных кишечных бактерий. Он содержит пептон, фенольный красный (индикатор рН), пробирку Дарема и один углевод. Мы используем три разных вида фенольных красных бульонов. Один содержит глюкозу; другой содержит лактозу, а последний содержит сахарозу. Цель упражнения - определить, какие организмы могут использовать каждый сахар. Фенольный красный - это индикатор рН, который становится желтым при значении рН 6,8 и фуксиевым при значении рН 7,4. Если организм способен утилизировать углевод, образуется побочный продукт - кислота , которая окрашивает среду в желтый цвет. Если организм не в состоянии утилизировать углевод, но использует пептон, побочным продуктом является аммиак, который повышает рН среды и окрашивает ее в цвет фуксии. Когда организм способен использовать углевод, может образовываться побочный продукт - газ. Если это так, пузырь воздуха будет захвачен внутри трубки Дарема. Если организм не в состоянии утилизировать углевод, газ не будет вырабатываться, и пузырьки воздуха не образуются.
Тест на случай заболевания
Агар из обезжиренного молока - это дифференциальная среда, которая проверяет способность организма вырабатывать экзофермент, называемый казеазой, который гидролизует казеин. Казеин образует в молоке непрозрачную суспензию, из-за которой молоко кажется белым. Casease позволяет организмам, которые его производят, расщеплять казеин на более мелкие полипептиды, пептиды и аминокислоты, которые могут проникать через клеточную мембрану и использоваться организмом. Когда казеин расщепляется на эти составляющие молекулы, он перестает быть белым. Если организм может расщеплять казеин, вокруг областей, где организм вырос, появится прозрачный ореол.
Тест на желатиназу
Питательный желатин - это дифференциальная среда, которая проверяет способность организма вырабатывать экзофермент, называемый желатиназой, который гидролизует желатин. Желатин широко известен как компонент желированных салатов и некоторых десертов, но на самом деле это белок, полученный из соединительной ткани. Когда желатин находится при температуре ниже 32 °C (или в пределах нескольких градусов ниже), это полутвердый материал. При температуре выше 32 °C это вязкая жидкость. Желатиназа позволяет организмам, которые ее вырабатывают, расщеплять желатин на более мелкие полипептиды, пептиды и аминокислоты, которые могут проникать через клеточную мембрану и использоваться организмом. Когда желатин расщепляется, он больше не может затвердевать. Если организм может расщеплять желатин, участки, где вырос организм, останутся жидкими, даже если желатин будет охлажден.
Тест на липазу
Трибутириновый агар - это дифференциальная среда, которая проверяет способность организма вырабатывать экзофермент, называемый липазой, который гидролизует трибутириновое масло. Липазы расщепляют липиды (жиры). Трибутириновое масло представляет собой тип липидов, называемых триглицеридами. В других тестах на липазу используются различные источники жира, такие как кукурузное масло, оливковое масло, арахисовое масло, яичный желток и соевое масло. Липаза позволяет организмам, которые ее вырабатывают, расщеплять липиды на более мелкие фрагменты. Триглицериды состоят из глицерина и трех жирных кислот. Они расщепляются и могут быть преобразованы в различные конечные продукты, которые могут быть использованы клеткой для производства энергии или других процессов. Трибутириновое масло образует непрозрачную суспензию в агаре. Когда организм вырабатывает липазу и расщепляет трибутирин, прозрачный ореол окружает области, где вырос организм, вырабатывающий липазу.
Гидролиз крахмала
Крахмальный агар - это дифференциальная среда, которая проверяет способность организма вырабатывать определенные экзоферменты, включая α-амилазу и олиго-1,6-глюкозидазу, которые гидролизуют крахмал. Молекулы крахмала слишком велики, чтобы проникнуть в бактериальную клетку, поэтому некоторые бактерии выделяют экзоферменты для разложения крахмала на субъединицы, которые затем могут быть использованы организмом. Крахмальный агар - это простая питательная среда с добавлением крахмала. Поскольку при гидролизе организмами крахмала в среде не происходит изменения цвета, мы добавляем йод в чашку после инкубации. Йод становится синим, фиолетовым или черным (в зависимости от концентрации йода) в присутствии крахмала. Просвет вокруг бактериального роста указывает на то, что организм гидролизовал крахмал.
Тройной сахарный железный агар
Железный агар с тройным сахаром (TSI) - это дифференциальная среда, которая содержит лактозу, сахарозу, небольшое количество глюкозы (декстрозы), сульфат железа и индикатор рН фенол красный. Он используется для дифференциации кишечных препаратов на основе способности снижать содержание серы и ферментировать углеводы. Как и в случае с красными бульонами для брожения фенола, если организм может сбраживать любой из трех сахаров, присутствующих в среде, среда станет желтой. Если организм может ферментировать только декстрозу, небольшое количество декстрозы в среде используется организмом в течение первых десяти часов инкубации. По истечении этого времени реакция, в результате которой образуется кислота, возвращается в аэробные области скоса, и среда в этих областях становится красной, указывая на щелочные условия. Анаэробные участки скоса, такие как задница, не вернутся в щелочное состояние, и они останутся желтыми. Это происходит с Сальмонелла и Шигелла
Тест на декарбоксилирование
Декарбоксилазный бульон проверяет выработку фермента декарбоксилазы, который удаляет карбоксильную группу из аминокислоты. Бульон с декарбоксилазой содержит питательные вещества, декстрозу (ферментируемый углевод), пиридоксаль (кофактор фермента декарбоксилазы) и индикаторы рН бромкрезол фиолетовый и крезол красный. Бромкрезол пурпурный становится фиолетовым при щелочном рН и желтеет при кислом рН. Мы также добавляем одну аминокислоту в каждую порцию бульона из декарбоксилазы. Три аминокислоты, которые мы тестируем в наших декарбоксилазных средах, - это аргинин, лизин и орнитин. Тест на декарбоксилазу полезен для дифференциации Enterobacteriaceae.Каждый фермент декарбоксилаза, вырабатываемый организмом, специфичен для аминокислоты, на которую он действует. Поэтому мы проверяем способность организмов продуцировать аргининдекарбоксилазу, лизиндекарбоксилазу и орнитиндекарбоксилазу, используя три разные, но очень похожие среды. Если организм не способен ферментировать декстрозу, в среде не произойдет изменения цвета. Если организм способен ферментировать декстрозу, образуются кислые побочные продукты, и среда становится желтой. Поскольку организмы ферментируют декстрозу, среда изначально становится желтой, даже если они были привиты организмом, положительным к декарбоксилазе. Низкий уровень pH и присутствие аминокислоты заставят организм начать декарбоксилирование. Если организм способен декарбоксилировать аминокислоту, присутствующую в среде, то образуются щелочные побочные продукты. Аргинин гидролизуется до орнитина и затем декарбоксилируется. Декарбоксилирование орнитина приводит к образованию путресцина. В результате декарбоксилирования лизина образуется кадаверин. Этих побочных продуктов достаточно для повышения рН среды, чтобы бульон стал фиолетовым. Если инокулированная среда желтого цвета или если нет изменения цвета, организм отрицателен к декарбоксилазе по этой аминокислоте. Если среда становится фиолетовой, организм декарбоксилаз-позитивен по этой аминокислоте.
Тест на коагулазу
Тест на коагулазу определяет, вырабатывает ли организм экзофермент коагулазу, который вызывает свертывание фибрина плазмы крови. Организмы, которые продуцируют каталазу, могут образовывать защитные барьеры из фибрина вокруг себя, делая себя очень устойчивыми к фагоцитозу, другим иммунным реакциям и некоторым другим противомикробным средствам. Тест на предметное стекло с коагулазой используется для определения присутствия связанной коагулазы или фактора слипания, который прикреплен к клеточным стенкам бактерий. Связанная коагулаза реагирует с фибриногеном в плазме, вызывая выпадение фибриногена в осадок. Это приводит к агглютинации клеток или слипанию, что создает "комковатый" вид при положительном тесте на предметное стекло с коагулазой. Возможно, вам потребуется поместить предметное стекло на световой короб, чтобы наблюдать слипание клеток в плазме.Тест на коагулазную пробирку был настроен как демонстрационный, чтобы вы могли наблюдать в классе. Эта версия теста на коагулазу используется для определения присутствия либо связанной, либо свободной коагулазы, которая является внеклеточным ферментом. Свободная коагулаза реагирует с компонентом плазмы, называемым фактором, реагирующим на коагулазу. В результате происходит свертывание плазмы. В демонстрации коагулазная плазма была инокулирована Золотистый стафилококк и Эпидермальный стафилококк и выдерживают при 37°C в течение 24 часов. Золотистый стафилококк производит свободную коагулазу; Эпидермальный стафилококк не. Тест на коагулазу полезен для дифференциации потенциально патогенных Стафилококки такие как Золотистый стафилококк из других грамположительных, каталазо-положительных кокков.
Иммунологическая диагностика
Реакции антиген — антитело являются высокоспецифичными и чувствительными. Это составляет основу иммунодиагностики. Эти инструменты используются для качественной и количественной оценки патогенов и /или защитных антител. Эти тесты могут использоваться на уровне фермы без помощи инструментов. Очевидно, что традиционные методы диагностики основаны исключительно на микроскопическом исследовании и его визуальном распознавании, что требует большого опыта работы с организмами, морфология которых часто так резко меняется в процессе их развития. Поэтому, в эволюции процедур диагностики заболеваний в аквакультуре иммунодиагностика на основе антител (белков) играет решающую роль. Этот метод имеет преимущество перед другими традиционными методами в том, что он может обнаруживать субклиническое / латентное / носительство инфекции, а также различать антигенные различия. Этот метод является относительно быстрым и более специфичным и чувствительным. Дальнейшее совершенствование традиционных методов иммунодиагностики привело к разработке методов на основе моноклональных антител, что повысило точность обнаружения и позволило изучить патогенез заболеваний. Тем не менее, специфичность антител также ограничивает их полезность, поскольку основные антигены не сохраняются на стадиях жизни определенных патогенов (Bartholomew et al., 1995). Хотя существует множество методов диагностики на основе поликлональных и моноклональных антител, доступных для различных патогенов водных животных.
- Тест на осаждение агарового геля,
- Тест на агглютинацию,
- ИФА,
- Точечный ИФА,
- Тест на латексную агглютинацию и
- Флуоресцентный тест на антитела.
Тест на осаждение агарового геля
В этом тесте антитела и возможные антигены помещают в лунки в агаровых чашках и дают им диффундировать друг к другу. Антитело помещают в центральную лунку, а антигены (специфические или неспецифические) - в окружающие лунки. Когда антитело и его специфический антиген встречаются друг с другом и находятся в нужных концентрациях, осадок образует видимую белую линию между двумя лунками. Эта линия называется линией преципитина.
Тест на агглютинацию
Этот тест используется для идентификации неизвестных антигенов; кровь с неизвестным антигеном смешивается с известным антителом, и независимо от того, происходит агглютинация или нет, помогает идентифицировать антиген; используется для сопоставления тканей и группировки крови и диагностики. В тесте на прямую агглютинацию сыворотку добавляют к суспензии клеток, поверхность которых самоагрегирована для тестирования. Если сыворотка человека содержит специфический ауто-Abs, Ig будет связываться, и при соответствующей концентрации Ab клетки станут сшитыми. Это вызовет агглютинацию, и клетки сформируют мат на дне тестовой лунки. Ауто-Абс, прикрепленные к клеткам пациента, могут быть обнаружены путем добавления второго Абс и наблюдения за агглютинацией. Селективные растворимые САМОАГ могут также использоваться для анализа АУТОАГ путем прикрепления их к поверхности эритроцитов. Этот последний тип теста на агглютинацию называется пассивной или непрямой гемагглютинацией.
ИФА
Цель ИФА - определить, присутствует ли определенный белок в образце, и если да, то в каком количестве. Существует два основных варианта этого метода: вы можете определить, сколько антител содержится в образце, или вы можете определить, сколько белка связывается антителом. Разница заключается в том, пытаетесь ли вы количественно определить антитело или какой-либо другой белок. В этом примере мы будем использовать ELISA, чтобы определить, сколько конкретного антитела присутствует в крови человека. Анализы крови проводятся на 96-луночных планшетах, что обеспечивает высокую производительность. Дно каждой лунки покрыто белком, с которым будет связываться антитело, которое вы хотите измерить. Цельной крови дают свернуться, а клетки центрифугируют для получения прозрачной сыворотки с антителами (так называемые первичные антитела). Сыворотка инкубируется в лунке, и каждая лунка содержит другую сыворотку. Положительная контрольная сыворотка и отрицательная контрольная сыворотка будут включены в число 96 тестируемых образцов. Через некоторое время сыворотку удаляют, а слабо прилипшие антитела смывают серией буферных промывок. Для обнаружения связанных антител в каждую лунку добавляют вторичное антитело. Вторичное антитело связывается со всеми человеческими антителами и обычно вырабатывается у грызунов. Ко вторичному антителу присоединен фермент, такой как пероксидаза или щелочная фосфатаза. Эти ферменты могут метаболизировать бесцветные субстраты (иногда называемые хромагенами) в окрашенные продукты. После инкубационного периода раствор вторичных антител удаляют, а слабо прилипшие антитела смывают, как и раньше. Заключительным этапом является добавление ферментного субстрата и получение окрашенного продукта в лунках со связанными вторичными антителами.Когда ферментативная реакция завершена, вся пластина помещается в устройство для считывания пластин и определяется оптическая плотность (т.е. количество окрашенного продукта) для каждой лунки. Количество выделяемого цвета пропорционально количеству первичных антител, связанных с белками на дне лунок.
ТОЧЕЧНЫЙ ИФА
Дот-ИФА (иммуноферментный анализ) является широко используемым иммунологическим инструментом в исследовательских, а также аналитических / диагностических лабораториях. При многослойном Дот-ИФА антиген помещается непосредственно между двумя антителами, которые реагируют с двумя разными эпитопами на одном и том же антигене. Здесь одно из антител иммобилизуется на твердой подложке, а второе антитело связывается с ферментом. Антиген в тестируемом образце сначала реагирует с иммобилизованным антителом, а затем со вторым антителом, связанным с ферментом. Количество связанных антител, связанных с ферментом, определяют путем инкубации полоски с соответствующим хромогенным субстратом, который превращается в окрашенный нерастворимый продукт. Последний осаждается на полоску в области активности фермента, отсюда и название Дот-ИФА. Активность фермента определяется интенсивностью пятна, которая прямо пропорциональна концентрации антигена.
Тест на латексную агглютинацию
Тест на латексную агглютинацию - это лабораторный метод проверки наличия определенных антител или антигенов в различных жидкостях организма, включая слюну, мочу, спинномозговую жидкость или кровь. При латексной агглютинации на поверхность частиц латекса наносится антитело (или антиген), известное как сенсибилизированный латекс. Когда образец, содержащий специфический антиген (или антитело), смешивается с сенсибилизированным латексом молочного цвета, это вызывает видимую агглютинацию
Флуоресцентный тест на антитела
IT это лабораторный тест, который использует антитела помечено с флуоресцентный краситель которые могут быть использованы для выявления наличия микроорганизмы. Этот метод обеспечивает прямое обнаружение антигенов с использованием флуоресцентно меченых антигенспецифических антител. Поскольку целью является обнаружение антигена в субстрате образца пациента (клеточный мазок, жидкость или культуральная среда, привитая пациентом), DFA редко является количественным.
Молекулярная диагностика
Молекулярные методы потенциально быстрее и чувствительнее, чем культуральные, серологические и гистологические методы, которые традиционно используются для идентификации патогенов рыб. В течение последних 15 лет или около того, молекулярные методы все чаще используются для диагностики болезней рыб. Эти методы включают полимеразную цепную реакцию (ПЦР), расщепление ферментом рестрикции, гибридизацию зондов, гибридизацию in situ и микрочип. Патогены могут быть обнаружены у бессимптомных рыб методами молекулярной диагностики, чтобы предотвратить вспышку заболевания. Таким образом, лечение антибиотиками может быть сокращено, так что создание устойчивых к антибиотикам бактерий может быть устранено. В этой статье рассматриваются молекулярные методы обнаружения патогенов рыб и обсуждаются возможности их применения. Применение новых методов в качестве обычного инструмента в диагностической лаборатории - это область, в которой недостаточно соответствующей литературы, и это может способствовать нежеланию некоторых применять эти методы.
Полимеразная цепная реакция
Полимеразная цепная реакция - это метод амплификации определенной области ДНК, определяемой набором из двух "праймеров", на которых синтез ДНК инициируется термостабильной ДНК-полимеразой. Обычно может быть реализовано по меньшей мере миллионократное увеличение определенного участка молекулы ДНК, и продукт ПЦР может быть обнаружен с помощью гель-электрофореза. Амплифицируемые области обычно имеют длину от 150 до 3 000 пар оснований (п.н.). Дизайн праймера важен для получения максимально возможной чувствительности и специфичности. Поэтому грунтовки должны быть достаточно длинными, чтобы выдерживать высокую температуру отжига и уменьшают возможность неспецифического отжига праймера, но слишком длинные праймеры могут способствовать неспецифическому отжигу даже в тех областях ДНК, которые не являются идеально комплементарными последовательности праймера. Реакция включает ДНК-матрицу, которая может быть в различных формах, от простого тканевого лизата до очищенной ДНК, праймеры, фермент полимеразу, катализирующий создание новых копий ДНК, и нуклеотиды для формирования новых копий. Во время каждого цикла реакции термоциклирования ДНК-матрица денатурируется, праймеры отжигают до их комплементарных областей, и фермент полимераза катализирует добавление нуклеотидов к концу каждого праймера, создавая таким образом новые копии целевой области в каждом раунде. Теоретически, увеличение количества продукта после каждого раунда будет геометрическим. Полимеразная цепная реакция с обратной транскриптазой (RT-PCR) используется для обнаружения специфической мРНК и определения уровней экспрессии генов. По сравнению с двумя другими широко используемыми методами количественного определения уровней мРНК, анализом Нозерн-блот и анализом защиты от РНКазы, ОТ-ПЦР может использоваться для количественного определения уровней мРНК из гораздо меньших образцов. Фактически, этот метод достаточно чувствителен, чтобы обеспечить количественное РНК из одной клетки. За последние несколько лет разработка новых химических препаратов и инструментальных платформ, позволяющих обнаруживать продукты ПЦР в режиме реального времени, привела к широкому внедрению RTPCR в режиме реального времени в качестве метода выбора для количественных изменений экспрессии генов. Кроме того, ОТ-ПЦР в режиме реального времени стала предпочтительным методом для подтверждения результатов, полученных в результате анализа массива и других методов, которые оценивают изменения экспрессии генов в глобальном масштабе. Чувствительность и специфичность, достигаемые при хорошо разработанном ОТ-ПЦР, делают его идеальным инструментом для наблюдения и мониторинга скрытых инфекций. Как и у эукариот, гены прокариотической рРНК содержат высококонсервативные последовательности. Давно признана потенциальная полезность консервативных областей для идентификации или амплификации генов рРНК с последующим использованием более вариабельных областей генов или спейсеров для обнаружения или идентификации бактерий, которые трудно или даже невозможно культивировать.
Мультиплексная ПЦР
Новые разработки, такие как разработка условий ПЦР, которые могут обнаруживать несколько патогенов одновременно в мультиплексной реакции, позволят увеличить время и экономическую эффективность этой методологии, опровергая один из основных аргументов против принятия этих методов в качестве рутинных. При мультиплексной ПЦР более одной целевой последовательности могут быть амплифицированы путем включения в реакцию более одной пары праймеров. Мультиплексная ПЦР потенциально может обеспечить значительную экономию времени и усилий в лаборатории без ущерба для удобства тестирования. С момента своего появления мультиплексная ПЦР успешно применяется во многих областях диагностики нуклеиновых кислот, включая анализ делеции генов, количественное определение и РНК. В области инфекционных заболеваний было показано, что этот метод является ценным методом идентификации вирусов, бактерий, грибков и паразитов.
Маркировка и обнаружение нуклеиновых кислот
Для зондов с нуклеиновыми кислотами существует множество систем маркировки и обнаружения. Когда-то радиоизотопы были нормой, но в интересах безопасности исследователей другие методы становятся все более популярными. Разнообразие меток и методов обнаружения, доступных в настоящее время, может обеспечить систему, подходящую для любого применения, от точечных пятен до гибридизации in situ. Они включают маркировку различными гаптенами, такими как биотин или дигоксигенин, и детекцию путем связывания антител в сочетании с флуоресцентными, хемилюминесцентными или колориметрическими методами детекции
Переваривание рестрикционными ферментами
Ферменты рестрикции (или рестрикция эндонуклеазы) расщепляют ДНК очень специфическим Мода. Ферменты рестрикции II типа, наиболее часто используется для анализа ДНК и генной инженерии, каждый имеют уникальную нуклеотидную последовательность, в которой он разрезает Молекула ДНК. Конкретный фермент рестрикции будет расщеплять ДНК в той единственной последовательности распознавания, которая часто используется палиндромная последовательность из шести пар оснований, но другие распознавать четыре или даже восемь последовательностей пар оснований. A обычно ферменты рестрикции используются для создания "отпечаток пальца" определенной молекулы ДНК. Потому что специфичности последовательности ферментов рестрикции, эти ферменты могут разрезать ДНК на отдельные фрагменты которые могут быть устранены с помощью гель-электрофореза. Это структура фрагментов ДНК генерирует "ДНК отпечаток пальца" и каждая молекула ДНК имеет свой собственный отпечаток пальца. Другие ферменты рестрикции могут быть использованы для дальнейшая характеристика конкретной молекулы ДНК. Расположение этих расщеплений фермента рестрикции сайты в молекуле ДНК могут быть скомпилированы для создания карта рестрикционных ферментов. Эти карты очень полезны для выявления и характеризующие конкретную плазмиду ДНК или область. Ферменты рестрикции распознают специфические короткие последовательности ДНК и расщепляют ДНК в этом месте. Изменения в одном нуклеотиде могут приводить к увеличению или потере сайта рестрикции, изменяя таким образом количество фрагментов, образующихся после расщепления ДНК. Эти RFLP можно визуализировать после гель-электрофореза переваренной ДНК для разделения фрагментов в соответствии с размером. Различия в профилях RFLP произвели революцию в уголовных расследованиях и стали мощными инструментами для идентификации лиц в случаях установления отцовства и материнства, популяционной генетики и диагностики различных заболеваний.
Полиморфизм длины рестрикционного фрагмента (RFLP)
RFLP - это метод, при котором организмы могут быть дифференцируются путем анализа закономерностей, полученных из расщепление их ДНК. Если два организма отличаются по расстояние между участками расщепления определенного эндонуклеаза рестрикции, длина фрагментов полученные результаты будут отличаться, когда ДНК переваривается с фермент рестрикции. Сходство паттернов сгенерированный может использоваться для дифференциации видов (и даже штаммы) друг от друга. Выделение достаточного количества ДНК для анализа RFLP является отнимает много времени и трудоемко. Однако ПЦР может использоваться для амплификации очень небольших количеств ДНК, обычно через 2-3 часа, до уровней, требуемых для RFLP анализ. Таким образом, большее количество образцов может быть проанализировано в более короткое время.
Полиморфизм длины амплифицированного фрагмента (AFLP)
Метод, основанный на быстрой ПЦР, AFLP может использоваться для типирования прокариот и эукариот. Метод основан на селективной ПЦР-амплификации фрагментов геномной рестрикции всего генома и, как было показано, является быстрым, воспроизводимым и с высокой степенью дискриминации. Выбранные маркеры амплифицируются с помощью ПЦР, что делает AFLP простым и быстрым инструментом для идентификации штаммов в сельском хозяйстве, ботанике, микробиологии и животноводстве. Используемый метод AFLP по существу соответствовал методу, описанному Вальсанджакомо et al., (1995). Анализ AFLP относится к категории методов селективной амплификации фрагментов рестрикции, которые основаны на лигировании адаптеров к фрагментам геномной рестрикции с последующей амплификацией на основе ПЦР с использованием специфичных для адаптера праймеров. Для анализа AFLP требуется лишь небольшое количество очищенной геномной ДНК; она переваривается двумя ферментами рестрикции, один из которых со средней частотой резки (как ЭкоRI) и второй с более высокой частотой резания (например MseЯ или TaqI). Двухцепочечные олигонуклеотидные адаптеры сконструированы таким образом, что исходный сайт рестрикции не восстанавливается после лигирования, что позволяет проводить одновременную рестрикцию и лигирование, в то время как религированные фрагменты снова расщепляются. Затем аликвоту подвергают двум последующим ПЦР-амплификациям в очень жестких условиях с использованием специфичных для адаптера праймеров, которые имеют на своих 3'-концах удлинение от одного до трех нуклеотидов, идущих в неизвестный фрагмент хромосомной рестрикции. Альтернативные процедуры типирования AFLP основаны на одном ферменте с одним адаптером и анализе с помощью электрофореза в агарозном геле. Значительное улучшение было достигнуто путем перехода с радиоактивных праймеров на флуоресцентно меченые праймеры для обнаружения фрагментов в автоматической последовательности. Кроме того, было показано, что для небольших бактериальных и грибковых геномов достаточно однократной ПЦР-амплификации с одним и двумя селективными нуклеотидами, соответственно, на обоих праймерах.
Случайная амплифицированная полиморфная ДНК (RAPD)
Технически сложный метод RAPD был применен для изучения грибка чумы раков, Astacus astaci . RAPD использует один праймер в полимеразных цепных реакциях низкой жесткости. Случайное связывание праймеров приводит к различным размерам фрагментов из образцов с неидентичной ДНК. Применение метода RAPD сгруппировало различные изоляты гриба и предоставляет средства для проведения эпидемиологических расследований (Lilley et al., 1997; Ойдтманн et al., 1999). Этот метод также использовался для изучения другого Aphanomyces виды, которые привели к серьезным потерям как выращиваемой, так и дикой рыбы в Азии (Lilley et al., 1997). С помощью RAPD были изучены другие патогенные микроорганизмы рыб, но проблемы с воспроизводимостью и риски загрязнения делают метод непригодным в качестве самостоятельного метода диагностики. Однако RAPD может быть полезным методом в качестве первого шага в разработке специфических праймеров или зондов и использовался таким образом при изучении бактерий.
Гибридизация In Situ
ПЦР In situ стала мощным молекулярным инструментом как в исследованиях, так и в клинической практике. Этот метод позволил лучше понять инфекционные и опухолевые заболевания и улучшить диагностику заболеваний. ОТ-ПЦР In situ дает более подробную информацию, позволяя высокочувствительно определять экспрессию генов с низким содержанием в данной клетке, предоставляя при этом анатомическую информацию. Полезность этих методов была затруднена низкой чувствительностью обнаружения, плохой воспроизводимостью и высоким фоном. Более того, многие методы, используемые для визуализации в результатах ПЦР-амплификации в клетках и тканях используются радиоактивные индикаторы, что делает выполнение методов громоздким и дорогостоящим. Исследователи разработали метод специфического флуоресцентного определения экспрессии генов с использованием ОТ-ПЦР in situ. Этот метод позволяет исследователю или клиницисту обнаруживать низкие уровни экспрессии генов в тканях с очень низким фоновым вмешательством, одновременно устраняя многие другие существующие недостатки использования ОТ-ПЦР in situ. Потенциальными областями применения являются обнаружение и диагностика вирусов и других инфекционных агентов в определенных типах клеток в тканях, обнаружение и характеристика опухолевых клеток в ткани, обнаружение и диагностика генетических мутаций при наследственных заболеваниях, а также обнаружение генов и экспрессии генов в ткани. Флуоресценция на месте гибридизация, или FISH, - это метод, используемый для маркировки клеток или хромосом в соответствии с последовательностями содержащихся в них нуклеиновых кислот. В микробиологии нуклеиновой кислотой, которая помечена как РНК или ДНК рибосом, и мишенью которой обычно являются целые клетки. Процесс работает путем взятия флуоресцентно меченых фрагментов ДНК или РНК, называемых зондами, длиной около 20 нуклеотидов. Зонды инкубируют в присутствии клеток в соответствующих условиях, чтобы обеспечить специфическую гибридизацию зонда с целевой нуклеиновой кислотой. Типы клеток, содержащие рибосомы с комплементарными последовательностями РНК, становятся помеченными путем связывания флуоресцентного зонда in situ. Затем эти меченые клетки можно визуализировать с помощью проточной цитометрии или флуоресцентной микроскопии.
Микрочипы ДНК
Существует ряд способов использования ДНК-микрочипов для обнаружения уникальных последовательностей ДНК (или РНК). Одним из методов является флуоресцентная маркировка всех последовательностей ДНК в тестируемом образце. Образец ДНК, который гибридизуется в определенном месте на микрочипе, может быть обнаружен с помощью детекции флуоресцентной матрицы, а данные проанализированы компьютерными программами. Часто более практичным является использование конкурентной гибридизации, при которой тестируемый образец конкурирует за гибридизацию с привязанным олигонуклеотидом на чипе с флуоресцентно меченым олигонуклеотидом-конкурентом . Когда тестируемая ДНК идеально дополняет привязанный олигонуклеотид, она гибридизуется с чипом. Когда тестируемая ДНК не является идеальной комплементарной привязанному олигонуклеотиду, флуоресцентно меченый конкурирующий олигонуклеотид будет связываться с привязанным олигонуклеотидом на чипе и вытеснять тестируемую ДНК. Затем детектор флуоресцентных микрочипов и компьютерная программа могут анализировать флуоресцентную матрицу на наличие или отсутствие последовательности ДНК, специфичной для вида / штамма. По сравнению с традиционной гибридизацией нуклеиновых кислот с мембранами, микрочипы предлагают дополнительные преимущества высокой плотности, высокой чувствительности, быстрого обнаружения, более низкой стоимости, автоматизации и низких фоновых уровней. Микрочипы могут обеспечить лучший вариант для крупномасштабного диагностического тестирования и могут одновременно исследовать образец на множество последовательностей. Поскольку большинство генетических последовательностей патогенов доступны в GenBank, олигонуклеотидные зонды, комплементарные всем патогенам, могут быть изготовлены и вставлены в микрочип, чтобы с помощью одного чипа микрочипа можно было обнаруживать различные микробы. В результате технология на основе микрочипов потенциально хорошо подходит для выявление патогенов рыб в популяциях рыб. Однако методы микрочипирования не требуют такого сохранения последовательности, поскольку все разнообразные последовательности генов из разных популяций одной и той же функциональной группы могут быть получены на матрицах и использоваться в качестве зондов для мониторинга заразных болезней рыб, особенно в бессимптомный период заболеваний. Микрочипы уже доказали свою ценность для анализа экспрессии генов. Большое количество зондов в массиве может выявить, какие гены экспрессируются или присутствуют в образце. Этот тип массива был бы особенно полезен при исследованиях патогенов, где наличие определенных генов или генных продуктов указывает на то, является ли организм патогенным или нет. Стоимость установки для использования микрочипов ДНК высока. Однако, как только оборудование будет доступно и будут подготовлены микрочипы, стоимость единицы анализируемой пробы будет низкой. Кроме того, время анализа чрезвычайно мало. Технология ДНК-микрочипов будет использоваться в будущем для диагностики болезней рыб, особенно в бессимптомный период заболеваний.
Петлевое изотермическое усиление (LAMP)
Петлевая изотермическая амплификация (LAMP) - это новый метод амплификации нуклеиновых кислот, который амплифицирует ДНК с высокой специфичностью, эффективностью и быстротой в изотермических условиях (Natomi et al., 2000). В сочетании с обратной транскрипцией этот метод также может с высокой эффективностью амплифицировать последовательности РНК. Метод основан на синтезе ДНК с автоциклическим вытеснением нитей с использованием ДНК-полимеразы с высокой активностью вытеснения нитей и набора из четырех специально разработанных праймеров. Эти четыре праймера, называемые внутренними и внешними, распознают шесть различных последовательностей ДНК-мишени, что повышает специфичность реакции. Реакция проводится в изотермических условиях, поскольку денатурация нитей происходит путем их смещения.
Реакция лампы: На начальных стадиях реакции LAMP задействованы все четыре праймера, однако в более поздней циклической реакции для синтеза ДНК со смещением нити используются только внутренние праймеры. Реакция LAMP инициируется внутренним праймером, содержащим последовательности смысловых и антисмысловых цепей ДНК-мишени. За этим следует высвобождение одноцепочечной ДНК посредством грунтовки внешним праймером. Эта одноцепочечная ДНК будет служить матрицей для синтеза ДНК, загрунтованной вторым внутренним и внешним праймерами, которые могут гибридизоваться на другом конце мишени. Этот процесс приведет к образованию структуры ДНК типа "ствол-петля". На следующем этапе циклирования LAMP один внутренний праймер гибридизуется с петлей на продукте и инициирует синтез ДНК со смещением нити, что приведет к исходной ДНК стержневой петли и новой стержневой петли. Цикл продолжается в течение примерно 1 часа и приводит к накоплению 109 копий цели. Конечными продуктами реакции являются ДНК в виде стержневой петли с несколькими перевернутыми повторами мишени и структуры, похожие на цветную капусту, с множеством петель.
Визуализация продуктов амплификации: Для визуализации конечных продуктов реакции LAMP можно использовать несколько методов. Наиболее распространенным методом визуализации является электрофорез в агарозном геле. Агарозный гель окрашивают интеркалирующими красителями, такими как бромистый этидий или сибриловый зеленый I. Поскольку конечные продукты LAMP состоят из ДНК с петлями-ножками и структурами, похожими на цветную капусту, с множеством петель различной длины, электрофорез в агарозном геле позволяет выявить продукты от минимальной длины целевой ДНК до загрузочной лунки, которая выглядит как мазок сверху и полосы у основания геля. Поскольку одной из характеристик реакции на ЛАМПЕ является ее способность синтезировать чрезвычайно большое количество ДНК, добавление интеркалирующего красителя SYBR Green I в саму реакционную пробирку помогло бы визуализировать продукт под УФ-трансиллюминатором. Этот метод полезен в полевых условиях, где гель-электрофорез будет ограничивающим фактором. Другой метод также основан на накоплении большого количества побочного продукта реакции. В реакции ЛАМПЫ образуется большое количество побочного продукта - иона пирофосфата, который дает белый осадок магния пирофосфат в реакционной смеси. Следовательно, обнаружение присутствия или отсутствия белого осадка обеспечит простое определение того, амплифицируется ли целевая ДНК во время реакции. Кроме того, поскольку увеличение мутности реакционной смеси в зависимости от образования осадка коррелирует с количеством синтезированной ДНК-мишени, колориметрическая оценка мутности в режиме реального времени также используется в качестве эффективного метода визуализации амплифицированного продукта.
Преимущества лампы: ЛАМПА амплифицирует ДНК-мишень при изотермической амплификации с высокой эффективностью; Предел обнаружения LAMP составляет несколько копий и сопоставим с ПЦР; Нет существенного влияния сопутствующей ДНК, не являющейся мишенью; ЛАМПА позволяет простое, понятное и селективное обнаружение; Лампа высокоспецифична для целевой последовательности, поскольку в ней используются четыре праймера, нацеленных на несколько последовательностей; ЛАМПА проста и удобна в выполнении, поскольку для реакции требуется (после приготовления соответствующих праймеров) только обычная лабораторная водяная баня или тепловой блок; Благодаря включению обратного транскрипция, LAMP также может быть использована для амплификации РНК.
Недостатки: Поскольку амплификация целевой ДНК на заключительном этапе очень высока, она уязвима для загрязнения при последующих амплификациях; Мультиплексирование с помощью LAMP невозможно.
Преимущества молекулярных методов
Помимо чувствительности и быстроты диагностики, основное преимущество методов молекулярной диагностики заключается в обнаружении некультивируемых агентов; Амплификация ДНК может помочь в обнаружении патогенов, присутствующих в небольших количествах, а также при обработке небольшого объема образца; Может использоваться для выявления скрытой инфекции и, таким образом, выявления резервуарных хозяев инфекции, что имеет важное значение в эпизоотии; Может использоваться для дифференциации антигенно сходных патогенов.
Недостатки молекулярных методов
Эти методы являются дорогостоящими процедурами; Эти тесты не могут обнаружить неожиданные образцы; Молекулярные методы будут испытывать трудности при обнаружении новых патогенов, поскольку их исключительное использование исключало бы такие инфекции.
Заключение
Методы диагностики патогенов водных животных продвинулись от микроскопической характеристики и морфологического описания к молекулярной характеристике и диагностике на основе зондирования. Молекулярные инструменты становятся все более актуальными для болезней рыб. Секвенирование полных геномов патогенов позволяет добиться значительных успехов в изучении биологии и улучшении диагностики и контроля патогенов. Использование нуклеиновой кислоты в качестве мишени и новые методы анализа полиморфизма в этой нуклеиновой кислоте могут улучшить специфичность, чувствительность и скорость диагностики и предложить средства изучения взаимосвязей между генотипом и фенотипом различных патогенов. Прогресс в методах помогает эпидемиологическим исследованиям, а также выявлению причин вспышек заболеваний или присутствия патогенов. Следовательно, молекулярная биология может быть обычным инструментом в поиске улучшенных методов диагностики и контроля патогенов рыб и эпидемиологии инфекционных болезней рыб.
-

-

-

-

-

-

-

-

-

-

-

-

-

-

-

-

-

-

-

-

-



